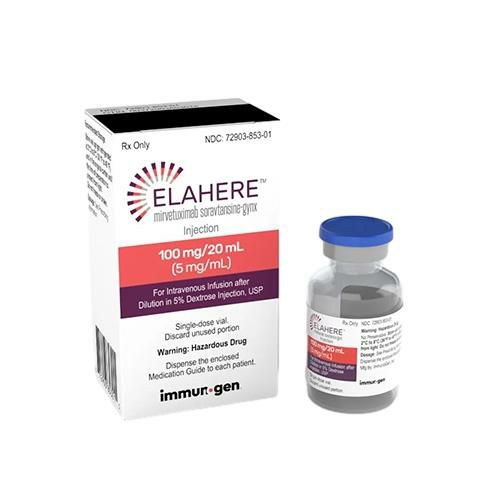
在探讨Elahere(别名:mirvetuximab soravtansine-gynx)在国内的上市情况之前,让我们先来了解一下这款药物的背景和重要性。Elahere是一种针对特定类型卵巢癌的靶向治疗药物,它的适应症为叶酸受体α(FRα)阳性、铂类耐药的上皮性卵巢癌、输卵管癌或原发性腹膜癌患者。这些患者通常已经接受过至少一种全身治疗方案,但仍需要更有效的治疗选择。
药物简介
Elahere是一种抗体药物偶联物(ADC),它由两部分组成:一部分是针对FRα的抗体,另一部分是与抗体连接的药物,可以直接作用于癌细胞,减少对正常细胞的损害。这种设计使Elahere在治疗FRα阳性的卵巢癌方面显示出了优势。
美国FDA批准情况
根据公开资料,Elahere在2022年11月获得了美国食品和药物管理局(FDA)的批准。这标志着Elahere成为全球首款获得完全批准的FRα ADC药物,为卵巢癌患者提供了新的治疗希望。
国内上市情况
截至目前,Elahere在中国尚未上市。2023年10月,华东医药股份有限公司收到国家药品监督管理局(NMPA)的《受理通知书》,意味着Elahere的上市申请已经进入审批阶段。这是一个令人期待的消息,因为它意味着国内患者可能很快就能使用这款新药。
临床试验数据
Elahere的批准主要基于MIRASOL临床3期验证试验的积极结果。在这项试验中,与研究者选择的化疗相比,Elahere在总生存期(OS)上显示出具有统计学和临床意义的改善。中位OS为16.46个月,相比之下,化疗组的中位OS为12.75个月,风险比(HR)为0.67,p值为0.0046。
不良反应
任何药物都可能引起不良反应,Elahere也不例外。根据临床试验数据,Elahere可能会导致包括视力障碍、疲劳、恶心等在内的副作用。然而,这些副作用的发生率和严重性在可控范围内,且医生会根据患者的具体情况进行管理。
结语
Elahere作为一种新型的靶向治疗药物,为卵巢癌患者带来了新的治疗选择。虽然目前在中国尚未上市,但已经进入审批阶段,未来有望惠及更多患者。对于价格信息,请咨询客服获得最新价格。
泰必达原创。发布者:泰健康,转转请注明出处:https://taibida.com/meds-info/143723.html
1.请注意,本站提供的医学产品信息并不完整,不能代替有资格的医疗专业人士所提供的咨询意见,不构成任何医疗建议或诊断。相关问题请咨询您的主治医生获得更多的帮助。本站内容作为纯介绍性信息仅供参考。 2.如有错误请联系客服修正,感谢您的支持和反馈!